医薬品開発担当者の視点からお届け るなの気になる!医療ニュースメモ |
第9回 新医薬品の薬価算定に至るまでの3つの道筋

令和4年度の診療報酬改定の基本方針が発表されました。
皆様、ご覧になられたでしょうか。
色々と記載がありますが、相変わらず薬価が減らされていますね。
今日はそんな診療報酬改定のたびに削減される薬価について取り上げたいと思います。
薬局の在庫管理の上でも迷惑この上ない薬価改定かと思われますが、その薬価が最初に決まるまでの基本的な3つの道筋について見てみましょう。
似ている薬は同じような薬価にする
規制当局の資料を参考に新医薬品の薬価算定に至るまでの大まかな流れを図示してみました。
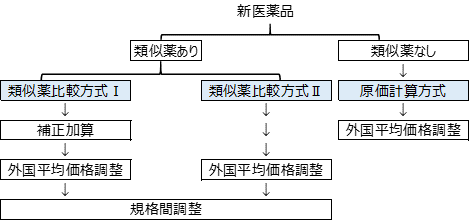
新医薬品の薬価算定までの道筋は大きく3つあります。
まずは類似薬の有無が大きなポイントです。
日本では似たような薬は同じような薬価にしよう! という考え方があるのです。
類似薬がある場合は「類似薬比較方式ⅠとⅡ」があります。
その中でもⅡというのは新規性が乏しい医薬品が分類される区分です。
率直に言うとⅡは大外れです。
これに分類されてしまうと、かなり薬価が抑制されてしまい、製薬企業としては非常に残念なことになります。
昔は「ゾロ新」といったちょっと側鎖を変えただけの新医薬品と呼んでいいのか微妙なものが多かったですが、今はそういう薬は評価されないような仕組みとなっているのです。
類似薬がない場合、つまりこれまでにないような、そのカテゴリーで初めてとなるような薬は「原価計算方式」で計算されます。
基本的にはこの仕組みが一番高い薬価となりやすいです(再生医療等製品等、一部の例外もあり)。
しかし高額の薬価が必ずしもこの仕組みで導き出されるとは限りません。
例えば1億円を超えて話題になったゾルゲンスマは原価計算方式ではなく、類似薬比較方式Ⅰで算定されています。
大まかな3つの道筋はお分かりいただけたでしょうか。
では次にそれぞれの算定方式の内容を簡単にまとめてみましょう。
類似薬比較方式Ⅰ
同じ効果を持つ類似薬がある場合には、市場での公正な競争を確保する観点から、新薬の1日薬価を既存類似薬の1日薬価に合わせるというルールです。
ここでいう比較薬は、原則として薬価収載後10年以内の新薬であって後発品が薬価収載されていないものを用いるとされています。
例えば、既存薬Aが1錠50円で1日3回服薬の場合は1日薬価は150円ですね。
新薬が1日1錠で済むのであれば、新薬の薬価は150円になるということです。
類似薬の要件
類似薬とは、下記の項目で類似性があるものとされています。
・効能及び効果
・薬理作用
・組成及び化学構造式
・投与形態、剤型区分
・剤型及び用法
さてこれだけでは新規薬剤を開発しても類似薬だと微妙ですよね。
これに大きく2つの分類の加算が加わります。
1.薬価の加算①
・画期性加算(70~120%)
いわゆる画期的な新薬の場合に該当します。
要は作用機序が新しかったり、有効性や安全性が優れている薬剤等の場合ですね。
しかしそんなに簡単ではなく、下記の要件を全部満たさないと、画期性加算はもらえません。
これまでにこの加算が適用されたケースはほとんどありません。
画期性加算の要件
・臨床上有用な新規の作用機序を有する
・類似薬に比べ、高い有効性/安全性を有することが客観的に示されている
・新薬における疾病/負傷に対し、治療方法の改善が客観的に示されている
・有用性加算Ⅰ(35~60%)
全てを満たしていないからといって、全く加算されないわけではなく、上記の画期性加算のうち、2要件を満たすものは有用性加算Ⅰが適用されます。
・有用性加算Ⅱ(5~30%)
画期性加算や有用性加算を満たさなくとも、下記のいずれかを満たす新薬は有用性加算Ⅱが適用されます。
・臨床上有用な新規の作用機序を有する
・類似薬と比べ、高い有効性/安全性を有することが客観的に示されている
・新薬における疾病/負傷に対し治療方法の改善が客観的に示されている
・製剤における工夫により、類似薬に比して、高い医療上の有用性を有することが、客観的に示されている。
薬価の加算①について見てきました。
続いて別の観点からの加算となる薬価の加算②を見てみましょう。
2.薬価の加算②
・市場性加算Ⅰ(10~20%)
希少疾患用医薬品であること、比較薬が市場性加算Ⅰを受けていないことなどが条件です。
希少疾患、つまり対象患者が少ない疾患については、売り上げが少なくなってしまうので、その分評価してくれるというわけです。
患者さんが少ないということは、薬価が与える医療経済的な影響も少ないため、加算しても大きな支障はないとも言えます。
・市場性加算Ⅱ(5%)
主たる効果/効能が市場規模の小さいものであること、比較薬が市場性加算Ⅱを受けていないことなどが条件です。
希少疾患とまでいかなくても、市場規模が小さい場合はおまけしてくれるということです。
・小児加算(5~20%)
用法用量に小児があること、比較薬が小児加算を受けていないことなどが条件です
小児の適応を取ることは難しいので(コスト面や安全性面などで治験が難しい)、その努力を評価してくれるわけです。
しかしこの程度では焼け石に水と言えます。
加算の面からだけで小児の開発を進めようというのは難しいと言わざるを得ません。
・先駆け審査指定制度加算(10~20%)
治療方法/診断方法の画期性、対象疾患の重篤性、対象疾患に係る極めて高い有効性、世界に先駆けて日本で早期開発・申請する意思(同時申請も含む)
そんな条件を満たす医薬品は、申請すれば先駆け審査指定制度の対象としてもらえる可能性があります。
先駆け審査指定制度は端的に言うと、承認申請にかかる時間を短縮することができる制度ですが、薬価の面でもおまけがあるのですね。
類似薬比較方式Ⅱ
同じ類似薬でも新規性に乏しい場合はⅡに分類されるケースがあります。
新規性に乏しい新薬については過去数年間の類似薬の薬価と比較して、もっとも低い価格とするという厳しいルールです。
ここに分類されると、控えめに言ってもかなり厳しいです。
以下の条件をすべて満たすものになります。
・新規性に乏しい新薬
・補正加算の対象外
・薬理作用類似薬が3つ以上存在
・最も古い薬理作用類似薬の薬価収載から3年以上経過
これに該当すると原則として、①または②のいずれか低い額となります。
① 過去6年間に収載された類似薬の最も安い1日薬価
② 過去10年間に収載された類似薬の1日薬価の平均価格
この価格が③を超える場合は更に④⑤を計算し、③④⑤で最も低い額に下げられます。
③ 類似薬効比較方式Ⅰによる算定額
④ 過去10年間に収載された類似薬の最も安い1日薬価
⑤ 過去15 年間に収載された類似薬の1日薬価の平均価格
踏んだり蹴ったりなこととなるわけですね。
原価計算方式
類似薬がない場合には、原材料費、製造経費等を積み上げていき、薬価を算定します。
例えば、原材料費、労務費、製造費、輸入原価、研究費、販売費、営業利益、流通経費、消費税等を勘案して決定します。
ここの研究費に基礎研究費や臨床試験費用、PMS費用などが含まれるわけです。
販売費の見込みについては、ざっくりした売り上げ予測を反映します。
別途資料を提示し、推定した売り上げの内容の妥当性についても検討されます。
重要なのは原価だけで計算されないということです。
たまに薬価が高すぎるということで、薬の原価が持ち出されることがありますが、医薬品の開発にかけるコストやその開発成功率を踏まえると、原価だけで計算されては全ての製薬企業はつぶれてしまうことになるでしょう。
外国平均価格調整について
類似薬効比較方式Ⅰ、原価計算方式のいずれの場合も、外国価格との乖離が大きい場合には、調整を行います。
ここでいう外国平均価格はアメリカ、イギリス、ドイツ、フランスの価格の平均額となります。
いわゆる先進国の価格を参照するということです。
調整対象要件は下記の2種類です
・外国平均価格の1.5倍を上回る場合→ 引下げ調整
・外国平均価格の0.75倍を下回る→引上げ調整
要は主要な先進国よりも費用の乖離が大きい場合にそれにすり合わせていくということですね。
その他、規格間の調整などを経て、薬価が決まっていくのです。
終わりに
今回は薬価が決まるまでに3つの道筋について見てきました。
普段扱われている医薬品の薬価がどのように決まってきたか、たまに思いを巡らせていただけますと嬉しいです。


